李載權周愛儒唐朝樞
【作者單位】:北京大學醫學部基礎醫學院生物化學與分子生物學系
《中國生物化學與分子生物學報》2004年03期
【摘要】:
內質網應激是導致心腦組織缺血梗塞、神經退行性疾病等發生的重要環節。目前發現同型半胱氨酸、氧化應激、鈣代謝紊亂等都能引起內質網應激級聯反應,表現為蛋白質合成暫停、內質網應激蛋白表達和細胞凋亡等。這些表現包括在未折疊蛋白反應(UPR)、整合應激反應(ISR)和內質網相關性死亡(ERAD)三個相互關聯的動態過程中,每一過程的分子機理現已逐步被揭示。作為細胞保護性應對機制的內質網應激體系一旦遭到破壞,細胞將不能合成應有的蛋白質,亦不能發揮正常的生理功能,甚至會出現細胞凋亡。掌握內質網應激過程對進一步理解多種疾病的發生機理有十分重要的理論意義。
內質網是哺乳細胞中一種重要的亞細胞器。膜/分泌性蛋白、氨基多糖、磷脂、膽固醇及鈣信號等的代謝均與內質網功能直接相關,例如分泌性蛋白的合成與空間折疊、蛋白質糖基化修飾、蛋白質分泌等均在內質網內發生。目前研究認為,胰腺細胞、心肌細胞、神經元細胞等內質網功能障礙可能分別是糖尿病、心腦組織缺血梗塞、退行性神經疾病等發生的重要原因。
內質網應激(endoptasmic reticulum stress,ERS)是指由于某種原因使得細胞內質網生理功能發生紊亂的一種亞細胞器病理過程,如蛋白質不能正確折疊。同樣,內質網中某一生理功能發生障礙如內質網內鈣流失或鈣超負荷,蛋白質糖基化形成障礙或蛋白質不能形成正常的二硫鍵等也可反過來誘發內質網應激,一般是用未折疊蛋白來提示內質網發生了應激反應。正常情況下,內質網內環境的穩定是實現內質網功能的基本條件,因此內質網具有很強的內穩態體系。盡管如此,但仍然有很多因素可導致內質網功能的內穩態失衡,形成內質網應激。例如缺血再灌注損傷、氧化應激、同型半胱氨酸(homocysteine,HCY)等化學物質處理、細胞內蛋白質合成過快以至于超過蛋白折疊能力、內質網鈣代謝紊亂、卵磷脂合成障礙等多種物理、化學或遺傳因素等都可成為內質網應激的重要誘因。此外,氨基酸剝奪、砷中毒、熱休克等細胞應激和線粒體鈣超載都與內質網應激有十分密切的聯系,這些縱橫交錯的關系共同組成了復雜的細胞內應激網絡體系。
1內質網應激早期蛋白質合成暫停
內質網應激引起內質網功能紊亂,包括內質網內未折疊蛋白或錯誤折疊蛋白的堆積等,其中由蛋白質堆積所引起的一系列后續反應稱為未折疊蛋白反應(unfolded protein response,UPR)。未折疊蛋白反應先表現為蛋白質合成暫停,隨著應激反應蛋白基因表達,可進一步改善細胞生理狀態。但當應激原強度超過細胞自身處理能力時,內質網也會誘導的內質網性細胞凋亡通路,以消除受損又不能及時修復的細胞,可見細胞內有一套完整的監測、應對內質網應激的體系,因此,所有內質網的應激反應實際上是一種細胞水平上的保護性手段(見Fig.1)。
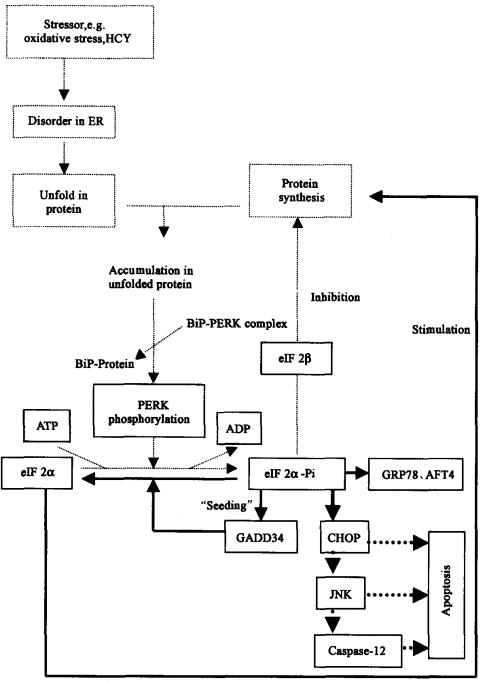
1983年Brostrom發現,將鈣離子添補到預先剝奪鈣離子的細胞培養基中再次培養該細胞時,細胞內蛋白質合成速度比補加鈣離子前明顯增加,起初他們認為蛋白質合成可能是一需胞漿鈣離子參與的過程,隨后他們加入一種能促進內質網鈣離子向胞漿轉運的工具試劑thapsigargin(TG,內質網鈣泵Ca2+,Mg2+-ATPase抑制劑,現常用來制備內質網因鈣丟失而形成內質網應激的一種工具試劑)以增加胞漿中鈣水平,結果TG的加入雖增加了胞漿內鈣離子水平但并未發現因此而能促進細胞內蛋白質的合成,相反與鈣離子剝奪培養基中的細胞一樣蛋白質合成仍然受到抑制;Brostrom等在對鈣通道蛋白載體表達細胞進行研究時,發現鈣離子能從胞漿重新復回到內質網,內質網鈣濃度維持穩定,因此細胞內蛋白質合成抑制現象得到明顯改善,內質網應激時蛋白質合成暫停發生十分迅速,是一數分鐘內即完成的早期事件。同樣,以能造成內質網功能障礙但并不影響胞漿鈣水平的其它工具試劑如DTY(二硫蘇糖醇,能干擾內質網內新生蛋白質二硫鍵的形成)和tunicamycin(能阻礙內質網內新生蛋白質糖基化修飾)等進行實驗。結果發現,所孵育的細胞中蛋白質合成受到抑制,這些現象歸納提示內質網內穩態失衡可能是導致蛋白質翻譯暫停的直接原因。
參與真核細胞蛋白質翻譯起始復合體eIF2(eukaryotic translation initiation factor 2)蛋白有α、β、γ三種亞基,其中eIF2α51位絲氨酸可被磷酸化修飾。正常情況下,eIF2α蛋白以GTP結合型征募(recruit)起始蛋氨酰tRNA到小亞基核蛋白體,形成小亞基核蛋白復合體,后者識別與結合模板mRNA,再裝配成具有蛋白質合成功能的核蛋白復合體。隨后GTP被降解,釋放GDP結合型eIF2蛋白。只有當GDP結合型eIF2蛋白經eIF2β作用重新轉換成GTP結合型eIF2蛋白時才能參與下一輪核蛋白復合體組裝與啟動工作,但是eIF2α蛋白51位絲氨酸發生磷酸化修飾后eIF2β就不能促進其GTP-GDP交換,因此,eIF2不能再被重復利用,從而抑制蛋白質合成的啟動過程。現在發現內質網應激、酵母細胞氨基酸饑餓、哺乳類動物細胞血紅素短缺、雙鏈RNA病毒感染均能通過eIF2α磷酸化途徑使蛋白質合成受到抑制,其中促進磷酸化修飾的特異性蛋白激酶分別是PERK(PKR-like ER kinase,PERK)、GCN2(general control non-derepressible-2)、HRI(hemereticulocytes inhibitor)和PKR(double strandRNA-dependent protein kinase)。
PERK屬Ⅰ型內質網跨膜蛋白,胞漿側羧基端的蛋白激酶活性既可使eIF2α磷酸化,又可使自身磷酸化,是PERK的主要功能區;而游離于內質網內的氨基端蛋白主要是感受內質網的應激信息。TG介導的內質網應激實驗證實了細胞內eIF2α磷酸化與蛋白質翻譯停止,蛋白質免疫印跡實驗進一步發現PERK電泳條帶遷移率較未經應激處理組降低,降低的PERK電泳條帶經堿性磷酸酶處理后遷移率恢復正常,說明PERK發生了磷酸化修飾;體外實驗證明,該PERK條帶的磷酸化來自PERK自身的催化活性,而不是其他激酶作用的結果;只有磷酸化的PERK才能使eIF2α蛋白51位絲氨酸磷酸化,經PERK作用使位于內質網外側eIF2α蛋白磷酸化可能是內質網應激時蛋白質合成抑制的重要原因。近來從人類胰腺細胞中發現有一種與PERK同源的蛋白PEK(pancmatic eIF2αkinase,PEK)也可對eIF2α磷酸化,對蛋白質的翻譯啟動同樣有抑制作用。
PERK蛋白感受內質網內應激的過程可能與免疫球蛋白結合蛋白BiP(immunoglobulin binding protein,orglucose regulating protein78,又稱為BiP/GRP78)的游離有關.內質網應激時大量未折疊蛋白或錯誤折疊蛋白質發生堆積,原來大量存在的而且主要與PERK結合的BiP轉而去應付未折疊蛋白,從而使PERK暴露、PERK間相互聚合、促進磷酸化發生,PERK自身激活并催化底物eIF2α蛋白發生磷酸化。Yamamoto研究發現高爾基體KDEL受體(一種幫助從高爾基體返回內質網的BiP運載蛋白受體)缺失時細胞內質網內因BiP大量丟失導致了蛋白質的合成抑制,提示蛋白質合成抑制可能與PERK充分暴露而被激活有關。
綜上認為,內質網應激時與PERK結合的BiP由于應付大量的未折疊蛋白質而使得內質網內PERK蛋白暴露,發生自身磷酸化與二聚化,活化的PERK蛋白進一步使內質網外側的eIF2α發生磷酸化修飾,磷酸化修飾的eIF2α不受eIF2β的GTP-GDP的交換作用,使得蛋白質合成啟動過程暫停。
2內質網應激中期整合應激反應的出現
大多數內質網應激時PERK因BiP參與未折疊蛋白的結合而被游離出來、PERK間聚合、然后激活下游eIF2α磷酸化,反饋抑制蛋白質合成的起始過程。蛋白質合成的暫停減輕了新生蛋白肽鏈對內質網蛋白質折疊需求的負荷與壓力,但這種抑制過程畢竟是一種臨時性防御措施。事實上內質網經較長時間應激暴露后,內質網應激蛋白如GRP78、GRP94以及GADD34(growtharrest and DNA-damage-inducible gene 34)、CHOP(C/EBP-homologousprotein,or growth arrest and DNA-damage-inducible gene153,GADD153)、ATF4(activatingtranscription factor-4)等表達增加,這樣可提高內質網應激細胞處理未折疊蛋白或抵御其它細胞應激的能力。磷酸化eIF2α蛋白與早期蛋白質合成暫停有關,但研究發現磷酸化eIF2α蛋白同樣與內質網應激中期應激蛋白的表達與蛋白質合成啟動的恢復也有關系,可見磷酸化eIF2α蛋白整合了包括內質網應激中期蛋白質合成中斷的恢復與應激蛋白的表達等所有后續反應,這類反應總稱為整合應激反應(integrated stress response,ISR),這種整合反應一般需1~2h才能完成。
整合應激反應中蛋白質合成中斷的恢復與磷酸化eIF2α蛋白脫磷酸作用有關。GADD34基因是許多細胞應激因素都能調控表達的一個基因,它編碼蛋白磷酸化酶Ⅰ復合體中的一個調節亞基,實驗證明GADD34具有使磷酸化eIF2α蛋白脫磷酸,即恢復蛋白質翻譯啟動的作用,例如TG較長時間處理eIF2α-/-型或PERK-/-型細胞,然后提取細胞內質網,用免疫印跡法檢測,結果均未能檢測到GADD34蛋白.而野生型細胞經TG處理后GADD34表達,說明GADD34蛋白是磷酸化eIF2α蛋白誘導表達的結果。Koiim等在GDD34基因水平將去磷酸化作用堿基序列刪除,建立轉基因小鼠GADD34aΔC/ΔC,然后以TG喂養GADD34ΔC/ΔC小鼠.結果發現細胞內eIF2α蛋白一直保持磷酸化狀態,蛋白質合成一直保持停止狀態,小鼠死亡率增加,而野生型小鼠eIF2α蛋白經歷短暫磷酸化后,迅速去掉磷酸根,同時蛋白質合成經歷約0.5~2h短暫的抑制后迅即回升。由此可見,GADD34參與了磷酸化eIF2α蛋白的去磷酸化作用,而且能使蛋白質的合成中斷得以恢復。
顯然GADD34基因的表達是整合應激反應中蛋白質合成中斷后重新恢復的重要環節,除GADD34蛋白表達外還有不少其它的內質網應激蛋白在內質網應激反應中期高表達。實驗研究發現TG處理野生型細胞時BiP/GRP78和GRP94高表達,但是TG處理GADD34ΔC/ΔC轉基因小鼠時GRP78和GRP94反而低表達;轉基因eIF2α-S52A細胞(該細胞eIF2α蛋白51位上不能被磷酸化)較相應野生細胞經TG較長時間作用后GRP78與GADD34表達也明顯減少,這些事實說明磷酸化eIF2α蛋白可能直接與應激蛋白高表達有關。因此,在內質網應激反應中期,由磷酸化eIF2α蛋白統一整合了包括調控內質網應激蛋白的表達與蛋白質合成啟動暫停的重新開始等在內的所有后續應激反應。
內質網應激時BiP/GRP78和GRP94以及ATF4、CHOP、GADD34等表達增加的機制是不能用GADD34介導的蛋白質合成中斷恢復模型加以解釋,因為表達增加的GADD34蛋白促進了磷酸化eIF2α蛋白的去磷酸化作用,進而使蛋白質合成中斷恢復的。研究發現,ATF4與GADD34等mRNA在細胞漿中本身大量存在,但是ATF4與GADD34等mRNA序列5’端存在特殊的上游開放閱讀框架(upstream open readingframes,uORFs)結構使得ATF4和GADD34通常總是處于翻譯抑制狀態,當出現內質網應激時,細胞漿中磷酸化eIF2α蛋白或IRE1(內質網應激時一種參與RNA變位剪接和eIF2蛋白磷酸化的雙功能酶)會激活ATF4和GADD34的mRNA上游閱讀框架結構,表達ATF4和GADD34蛋白。但是激活的這些特殊結構mRNA如何在蛋白質合成普遍性抑制下進行翻譯的分子機理目前還不十分清楚,推測細胞內可能預先存有微量GADD34作為“種子”,通過“種子”引導的eIF2α蛋白去磷酸化作用和mRNA分子中具有uORF結構的內質網應激蛋白優先表達,使內質網的應激蛋白得到表達。
3內質網應激后期引起內質網性細胞凋亡的發生
內質網應激細胞隨著整合應激反應的進一步演進,細胞一方面積極調動應激反應蛋白以抵御應激誘因所造成的有害影響,同時調整內質網功能以適應新的內環境變化要求,另一方面也會表達一些有可能導致細胞死亡的應激蛋白調節基因如CHOP等,根據情況決定后面清除那些根本無法恢復到正常功能狀態的內質網應激細胞。內質網應激引起細胞死亡,通過細胞凋亡作用來摧毀這些受損的細胞可能是解決內質網應激受損細胞不得已的措施。
線粒體細胞凋亡過程先是促進細胞內凋亡蛋白如P53、Bax、Par-4的表達活化,這些凋亡蛋白促進線粒體膜通透性增加,釋放細胞色素c,后者再活化蛋白水解酶caspase-3等,引起細胞凋亡解體。內質網應激引起的細胞凋亡不同于線粒體細胞凋亡,有一套自身的信號傳遞通路,稱為內質網相關性死亡(ER-associated death,ERAD)途徑。READ途徑包含內質網應激誘導CHOP/GADD153表達、JNK(c-Jun NH2-terminal kinases,JNK)的活化和/或caspase-12蛋白水解酶的活化。
CHOP/GADD153蛋白與JNK是聯系內質網應激與細胞凋亡的重要中間信號分子,caspase蛋白水解酶是執行細胞凋亡作用的終末分子。CHOP基因啟動子上具有氨基酸應答元件(amino acid responseelement,AARE),氨基酸剝奪或內質網應激等許多因素分別通過AARE或其他相關元件來調節CHOP蛋白表達,CHOP蛋白或與C/EBP或與Jun/Fos家族蛋白成員形成雜二聚體,調節下游凋亡相關基因的表達。實驗證明TG長時間作用細胞時CHOP大量表達且進一步導致細胞生長停滯和細胞死亡,在刪除CHOP蛋白轉錄調控區的轉基因細胞中加入TG后長時間作用發現細胞凋亡反而明顯減弱,表明CHOP介導了TG內質網應激時的細胞凋亡過程。JNK能對底物c-JUN或AFT2等轉錄因子氨基末端進行磷酸化修飾、激活這些轉錄因子以調節下游基因的表達。實驗表明同型半胱氨酸(HCY)劑量依賴性引起內皮細胞的內質網應激與細胞凋亡,其中IRE1-JNK-ATF3途徑參與了細胞凋亡的激活過程。Caspase蛋白水解酶(半胱氨酸天冬氨酸酶簡稱)屬白介素1β轉換酶(interleukin-1beta converting enzyme,ICE)家族,是執行細胞凋亡的水解酶。目前發現該家族共14個成員,各自作用不同,但彼此間形成級聯反應系統,其中caspase-9居這個凋亡信號系統中的樞紐位置,caspase-3負責拆卸細胞等,capase-12僅產生于內質網,并僅在內質網內活化蛋白水解酶.TG處理細胞時內質網caspase-12酶活性升高,然后caspase-12從內質網轉運到胞漿,在胞漿激活caspase-9和caspase-3等,之后引發細胞凋亡。通常伴侶蛋白BiP與caspase-7和caspase-12形成復合體,細胞不會表現凋亡,但是內質網應激時BiP減少可以誘發細胞凋亡,說明caspase-12暴露活化也可引起細胞凋亡。
目前內質網應激引起細胞凋亡的基礎研究仍在不斷發展,原認為凋亡分子Bax和Bak僅存在于線粒體外膜,現發現同樣存在于內質網外膜上;TG可分別刺激內質網與線粒體上Bax和Bak蛋白引起構象變化與二聚化,無論是經內質網或線粒體引起的Bax和Bak蛋白活化均可介導細胞凋亡,但是引起細胞凋亡的途徑不完全相同,如經內質網Bax分子僅引起內質網的caspase-12和鈣離子所參與的細胞凋亡過程;經線粒體Bax介導的細胞凋亡主要由caspase-7和PARP分子參加的凋亡過程,提示內質網應激性細胞凋亡可能是與線粒體性細胞凋亡不同的細胞信號傳導途徑。
4臨床疾病的研究與展望
家族性帕金森氏病患者神經細胞中存在帕金蛋白(parkin)的突變體形式。parkin蛋白本身具有泛素連接酶E3(E3 ubiquitin ligase)功能,能促進神經元細胞中神經毒性蛋白如長鏈多聚谷氨酰胺蛋白(anexpanded polyglutamine protein)的降解,但是帕金森氏病患者Parkin突變體沒有泛素連接酶E3的作用,因此不能及時清除神經細胞中神經毒性蛋白,內質網神經毒性蛋白堆積發生應激,長期內質網應激進一步加重神經細胞的凋亡,這可能是帕金森氏病發生的一個重要環節。
我們在小鼠腹腔注射HCY復制的高同型半胱氨酸血癥模型上測定了小鼠組織金屬硫蛋白(metallothionein,MT)含量的變化.結果發現,HCY能通過氧化應激作用誘導MT生成,金屬硫蛋白與伴侶蛋白GRP78同樣是抗氧化應激的重要細胞保護分子。高同型半胱氨酸是強烈的內質網應激原,早期能刺激細胞外基質中超氧化物歧化酶表達,晚期刺激GRP78表達,我們推測高同型半胱氨酸刺激金屬硫蛋白表達可能是細胞內質網應激蛋白表達的一部分,血管平滑肌細胞受到氧化應激也會有內質網應激進而對細胞增殖產生影響。
Shibata在小鼠中腦動脈血管暫時性梗塞模型中發現,1 h梗塞后缺血再灌注時Bip/GRP78表達增加,5 h梗塞后缺血再灌注則caspase-12表達增加,免疫印跡實驗發現神經組織細胞凋亡TUNEL陽性與caspase-12陽性共存,證明內質網應激后由caspase-12引起了神經細胞凋亡。Hayashi在下丘腦缺血灌注預處理(preconditioning)后第2天大鼠腦組織中發現伴侶蛋白GRP78表達增加,PERK磷酸化延遲,神經細胞死亡降低,提示缺血灌注預處理的細胞保護可能與內質網應激有關。
新研究還表明,內質網應激是線粒體應激發生發展的始動環節,因此有必要重新評價心腦血管病、老年癡呆、糖尿病等多種疾病發生的線粒體應激機理。同樣內質網應激作為重要而基本的細胞保護手段,因此針對內質網應激環節對這些疾病治療方案的全新設計將會有進一步的發展。