——活性氧與細胞的增殖、分化和凋亡及其信號轉導途徑
景亞武易靜高飛湯雪明
《細胞生物學雜志》2003年04期
【作者單位】:上海第二醫科大學細胞生物學教研室
上海第二醫科大學細胞生物學教研室
上海第二醫科大學細胞生物學教研室
上海第二醫科大學細胞生物學教研室
【摘要】:
活性氧(reactive oxygen species,ROS)是生物體有氧代謝產生的一類活性含氧化合物的總稱,主要包括O2·-、H2O2、·OH等,機體細胞通過多種途徑維持ROS產生與消解的動態平衡。近年的研究揭示ROS參與細胞正常的生理過程,與細胞的增殖、分化及凋亡密切相關。不同刺激誘導細胞產生的內源性ROS可作為第二信使,通過改變氧化還原狀態調節增殖、分化和凋亡相關的信號轉導通路中多種靶分子的活性,決定細胞的命運。
細胞的增殖、分化和凋亡是真核細胞基本的生物學行為,不同的外來信號(或其組合),通過一系列信號轉導途徑,決定細胞走向增殖、分化或者凋亡。長期以來,活性氧(reaetive oxygen species,ROS)被認為只是一類損傷細胞的毒性物質,近年的研究發現,ROS參與了對細胞增殖、分化和凋亡的信號轉導,從而參與了這些重要細胞活動的調控,本文就此作一綜述。
一、細胞內活性氧的生成及其調控
1.細胞內活性氧的生成
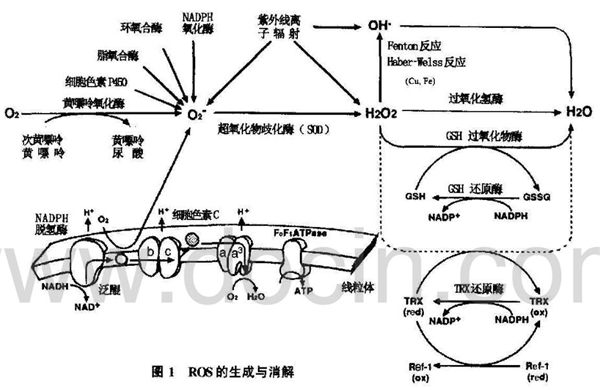
氧氣是多數生物體生命活動的基礎物質之一,其作用是參與能量代謝,主要是參與線粒體的呼吸和氧化磷酸化,生成ATP,其終產物主要是水。但是,氧氣代謝過程中還可產生一系列中間產物,包括氧自由基如超氧陰離子(O2·-),羥自由基(·OH),以及過氧化氫(H2O2)和單線態氧(1-O2)等,這些物質具有較強的氧化能力,統稱為ROS。
線粒體是多數真核細胞產生ROS的主要部位,在有氧呼吸過程中,大部分電子沿呼吸鏈傳遞至末端與分子氧結合生成水,但一小部分電子(2%~3%)可由呼吸鏈酶復合體Ⅰ和Ⅲ處漏出,使得分子氧單電子還原,生成具有較強氧化作用的超氧陰離子(O2·-),并通過特定的化學反應生成羥自由基(·OH)、過氧化氫(H2O2)等。實際上,大部分ROS的起初來源都是O2·-。
正常狀態下,線粒體ROS的生成速率主要受線粒體內膜跨膜電位Δψm的控制。近來發現,線粒體中調節氧化磷酸化偶聯效率的解偶聯蛋白(Uncouplingprotein,UCP)可以引起跨膜H+梯度(ΔμH+)的消解而沒有任何能量的產生(稱為“質子漏”),這種溫和的解偶聯(mild uncoupling)引起的“質子漏”可直接降低線粒體Δψm,使得ROS的生成速度降低。
結合在細胞質膜上的酶復合體NADPH氧化酶是產生O2·-另一重要部位,主要由胞漿中的P47phox、p67phox和Rac1/2以及胞膜上的gp91phox和P21phox組成。起初發現該酶復合體存在于吞噬細胞,在外界信號(如細菌脂多糖,細胞因子TNF-α、IL-1、IFN-γ等)作用下迅速活化,產生大量的ROS,形成氧化爆發,以清除入侵的病原微生物。
新近有報道指出,具有NADPH/NADH氧化酶活性的酶也存在于許多非吞噬細胞中。機體多器官平滑肌均發現gp91phox的同源物Nox1,且在小鼠NIH3T3細胞中過表達Nox1,ROS的產生增多。由于NADPH氧化酶具有激活快、失活也快的特點,故認為其產生的ROS可能作為信使分子,在調節機體細胞增殖、分化和凋亡相關的信號傳導過程中具有更為重要的意義。
此外,細胞的內質網及一些酶類例如,環氧合酶、脂氧合酶、γ-谷氨酰轉肽酶以及黃嘌呤/次黃嘌呤氧化酶系統等也可通過特定的化學反應產生O2·-。
2.細胞內活性氧的消解
(1)抗氧化酶系統及抗氧化小分子
參與抗氧化應激的酶系統主要包括超氧化物歧化酶(SOD)、CAT。SOD包括位于線粒體的Mn-SOD和位于胞漿的Cu/Zn-SOD,主要催化兩分子的O2·-形成—分子H2O2和一分子O2。CAT位于過氧化物酶體中,主要催化H2O2形成H2O和分子O2。
此外,一些小分子物質如維生素A、C、E也參與清除氧自由基,防止脂質過氧化,是機體抗氧化防御系統重要的一部分。
(2)巰基還原緩沖體系
還原型谷胱甘肽(GSH)是細胞內分布更廣的非蛋白類巰基抗氧化物,通過NADPH依賴的谷胱甘肽還原酶(GR)的催化作用,細胞內還原型GSH與氧化型GSSG保持動態平衡,并已成為表征細胞抗氧化能力的一個重要指標。
硫氧還蛋白(Trx)及其還原酶TrxR,是細胞內抗氧化巰基還原緩沖體系的另一重要成員。Trx的催化活性部位(-Cys-Gly-Pro-Cys-)含有特征性的對氧化還原敏感的半胱氨酸-SH/S2,正常生理狀態下,還原型Trx主要位于胞漿,催化各種底物蛋白的二硫鍵還原為巰基。近期也發現各種刺激引起胞內ROS增高時,Trx易位入核,并直接催化胞核中某些轉錄因子DNA結合域中半胱氨酸殘基(Cys)還原,提高其促進轉錄的活性,但其確切的轉位機制尚不清楚。
細胞內活性氧的生成及消解見圖1。
3.細胞的氧化還原平衡
細胞的氧化還原狀態常表達為oxidation/reductionstate,或Redox state,正常情況下,機體細胞ROS的產生與消解處于一種動態平衡過程中,細胞內環境氧化還原狀態相對穩定。各種刺激(如炎癥、紫外線等)引起矛盾雙方任何一方力量的相對增強,必將引起細胞氧化還原狀態的改變,通過相應的信號轉導途徑,導致相關基因表達水平的改變,細胞表現不同的生物學效應。
二、活性氧與細胞的增殖、分化和凋亡
早期認為,ROS是細胞有氧代謝的“副產品(byproducts)”,其主要效應是攻擊胞內生物大分子,具有一定的細胞毒作用,而細胞內的抗氧化系統把這種毒性效應限制在一定范圍之內。近年的一系列研究表明,細胞內ROS水平的輕微增高促進細胞的增殖和分化,而胞內ROS水平的顯著增高則快速觸發細胞的凋亡。由此可見,細胞內ROS的產生可能不是—種“副產品”,而是“目的性(purposeful)”的產物,在這些過程中,ROS的角色是細胞內一類重要的信號分子。
ROS與細胞增殖的關系在10余年前開始受到關注,新近更是不斷有文獻報道。例如,在各種生長因子如EGF、PDGF、FGF等引起細胞增殖(平滑肌細胞、肝細胞、PC12細胞等)的同時,往往伴有ROS的產生。又如,直接給予低濃度外源性的H2O2或O2·-同樣可以引起平滑肌細胞、成纖維細胞等迅速增殖;而一定程度上干預細胞ROS的產生則抑制其增殖。
新近幾年ROS與細胞分化的關系亦研究較多,特別是腫瘤發生與防治的深入研究為這方面提供了的大量證據。如抗腫瘤藥物丁酸、阿霉素引起的胞內ROS水平改變是誘導人類K562細胞分化為成熟紅細胞的關鍵一步;同樣NGF誘導鼠PC12細胞分化為神經細胞,IL-1誘導胚胎干細胞分化為心肌細胞的過程中均有ROS的產生。
ROS與細胞凋亡的關系研究由來已久,近年來更有大量證據表明ROS參與了多種類型的細胞凋亡。例如,多種凋亡刺激因子(如TNF-α、As2O3等)都可刺激ROS水平的增高,許多ROS的消解劑如GSH、SOD等,均可在一定程度上拮抗凋亡。不少證據還支持ROS參與了凋亡誘導早期線粒體的變化。
三、ROS參與增殖、分化、凋亡相關的信號轉導途徑
1.引起細胞內ROS水平增高的信號
胞外多種刺激信號均以細胞內ROS作為第二信使,調節細胞走向增殖、分化和凋亡。這些信號主要分為兩大類:化學信號和物理信號,前者包括生長因子、細胞因子和激素等,通過與膜上相應的受體分子結合,引起細胞內ROS水平增高,進而激活相關的信號通路,主要參與生理情況下細胞正常的增殖、分化和凋亡的調控。后者包括紫外照射、離子輻射、熱、滲透壓和機械刺激等,產生的外源性ROS擴散入細胞,或同時激發內源性ROS生成,主要參與應激情況下細胞穩態的調控。
2.細胞信號轉導通路
細胞中具有多種信號轉導系統,如分裂原激活的蛋白激酶(mitogen-activatedprotein kinases,MAPKs)、Smads及JAK/STAT等,其中MAPKs家族與增殖、分化、凋亡的發生密切相關,并且是重要的氧化還原敏感的(redox-sensitive)信號通路,因此本文對其進行詳細介紹。
迄今為止發現的MAPKs信號轉導通路主要包括細胞外信號調節激酶(ERK)、c-Jun N端激酶位激激活的蛋白激酶(JNK/SAPK)和P38MAPK三條途徑,其共同特征是都包含三個保守的蛋白激酶成分。在胞外刺激信號的作用下,三級蛋白激酶成分順序激活(MAPKKK→MAPKK→MAPK)。至后激活轉錄因子,調節特定基因的表達。盡管具有相似的激活機制,但每條途徑都有其特異的上游激活劑和相應底物,產生不同的生物效應,如ERK主要接受生長因子的刺激,通過Raf→MEK→ERK通路激活轉錄因子,其中主要是活化蛋白-1(AP-1)和核因子kappa B(NF-κB)的活性,介導細胞增殖和分化的信號轉導;而JNK和P38MAPK主要感受炎癥、氧化應激及損傷等刺激,分別通過MEKK1→MKK4/MKK7→JNK/SAPK或MEKKs/TAK→MKK6/3→P38MAPK,激活核內的轉錄因子,進而誘導保護性蛋白的生成,增強細胞對應激原的抵抗力,或介導細胞凋亡。新近發現的MAPKs家族的第四種成員,即分裂原激活的大分子蛋白激酶(BMK1/ERK5),可能也參與調控應激情況下細胞的反應,但對其上游激酶及下游底物成分尚無確切的認識。
3.ROS作用的靶分子
盡管ROS參與細胞增殖、分化和凋亡相關的多條信號通路的調控,但ROS作用的確切部位尚未闡明,目前越來越多的證據顯示,ROS可能通過改變氧化還原狀態,調節信號轉導通路中從細胞膜到細胞核不同水平多種信號轉導分子的活性,完成其信使分子的功能。
(1)MAPKs級聯反應
A.通過磷酸化/脫磷酸化調控
信號傳遞過程中,各級信號轉導蛋白同時受到上游蛋白激酶和相應的磷酸酶的雙重調節,其活性部位(主要是絲/蘇氨酸或酪氨酸殘基)可逆的磷酸化/脫磷酸化是傳遞信號的基礎。
MAPKKK具有絲/蘇氨酸蛋白激酶的活性,是信號傳遞過程中一類重要的激酶;相應的,細胞內也有一系列的絲/蘇氨酸蛋白磷酸酶(PPs)對抗其磷酸化作用。如PPs中的PP2A的活化抑制ERK1/2及MEK1/2的活化,PP2C的活化抑制JNK及P38MAPK的活化。繼續深入研究卻發現H2O2對PP2C酶的活性無明顯的抑制,卻引起P38的活化,因此是否在信號通路中存在其他氧化還原敏感的PP酶有待進一步考察。
雙特異激酶MAPKK及其上游蛋白激酶如胞膜的受體酪氨酸激酶(RTKs)和胞漿的Src家族、JAK家族等小分子都具有酪氨酸激酶(PTKs)的活性,同時細胞內也有一系列的蛋白酪氨酸磷酸酶(PTPs)對抗PTKs的磷酸化作用。越來越多的資料提示細胞內ROS水平增高或相對的氧化狀態可引起PTKs的活性增強,但迄今為止尚無充足的證據表明ROS直接激活RTKs和PTKs等激酶,因為用H2O2直接作用于PTKs并不能增加其酶活性,卻迅速引起PTPs的失活,予以GSH或其他巰基類還原劑后PTPs的活性恢復,而小劑量的H2O2抑制PTPs后PTK的活性增強,因此認為,ROS通過抑制PTPs的活性間接激活PTKs(圖2)。已經發現,所有PTPs的催化活性部位都含有一個保守的cys(C124),胞外刺激信號引起的細胞內ROS水平增高,可直接氧化或通過氧化型GSSG間接氧化cys上的-SH(cys-SH),分別形成-SOH或-SSG,造成PTPs失活。
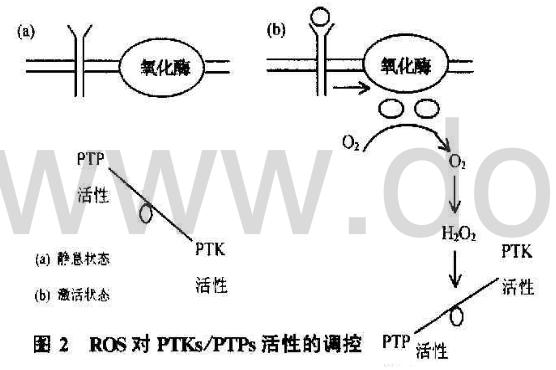
B.通過氧化還原敏感元件調控
ASK1是JNK和P38通路中MKK3/6、MKK4/7的上游蛋白激酶(MAPKKK),在生理情況下,細胞漿處于相對還原的狀態,此時Trx與ASK1氨基端結合并抑制其激酶的活性。氧化應激或TNF等引起的胞內ROS增高,可通過兩種機制調節ASK1的活性:一方面ROS引起Trx的二聚化并與ASK1分離,另一方面ROS可直接催化ASK1的cys-SH氧化,兩分子ASK1通過分子間二硫鍵形成同源二聚體,酶的活性恢復,激活下游MAPKK,凋亡信號得以繼續傳遞。
同樣JNK的氧化激活也受到類似的調節,正常情況下,細胞內富含cys的氧化還原敏感元件GSTp與JNK結合并抑制后者的磷酸化,紫外照射或低濃度H2O2的刺激下,GSTp寡聚化并與JNK分離,JNK的活性得到恢復。
C.通過Ca2+調控
同為第二信使,Ca2+與ROS之間的關系越來越受到人們的關注。目前大量的資料提示ROS可能通過直接影響胞內Ca2+濃度的變化調節下游基因的激活或轉錄下調。
(2)轉錄因子的氧化還原調節
轉錄因子中許多為氧化還原敏感的,即它們的活性受細胞氧還狀態的調控,這些氧化還原敏感的轉錄因子如NF-kβ、AP-1、P53等都含有保守的cys,人們猜測活性cys的巰基開關可能直接調節基因的表達。
NF-κB是很早發現的與細胞氧化還原狀態密切相關的轉錄因子,通過調節多種蛋白的表達,參與細胞增殖、分化、凋亡、炎癥及免疫等多種生物學效應。靜息狀態下,NF-κB由P65、P50和抑制亞基I-κB組成,定位于胞漿,在外來信號的作用下,I-κB磷酸化,并被遍在蛋白輟合酶降解,NF-κB活化入核,并與特異的DNA結合,調節其表達。研究發現,胞漿中抑制亞基I-κB的降解是NF-κB活化的關鍵,而入核后NF-κB與DNA的特異結合則是調節基因表達的決定性因素。胞內ROS增高或細胞處于相對氧化的狀態,一方面通過增強遍在蛋白輟合酶的活性,促進I-κB的降解;另一方面卻通過氧化P50亞基cys抑制NF-κB與DNA的結合。如dithiothreitol預處理抑制TPA引起的NF-κB的活化,應用谷胱甘肽還原酶抑制劑GR后,這一效應被部分逆轉,相反在TPA處理1小時后加入dithiothreitol,NF-κB的活化效應得到增強提示NF-κB激活過程中從胞漿易位至胞核存在氧化型向還原型的轉變,且P50亞基還原型cys62是NF-κB與DNA有效結合的重要保證,這就產生了一個矛盾,即轉錄因子的激活需要氧化狀態的存在而轉錄因子與DNA的結合則需保持還原狀態。
目前認為,Trx和GSH參與調節NF-κB在胞漿與胞核不同的氧化還原狀態,主要依據是:
(1)含有活性cys的Trx表面具有靴狀中空結構,可特異識別NF-κB P50亞基DNA結合域的loop結構,并作為質子供體促進氧化型cys的還原。
(2)氧化應激可促使Trx由胞漿易位入核。
(3)共轉染hTrx與LTR-driven報告基團,依賴于NF-κB的報告基團表達增多。
同樣,氧化應激或胞內GSSG增高引起轉錄因子AP-1的活化,但抑制其與DNA的結合。與NF-κB不同,Trx不能直接作用于AP-1,但可通過對另—種核蛋白Ref-1的氧化還原調節增強AP-1與DNA的結合能力。其他含cys的轉錄因子如P53、腎上腺皮質激素受體也受到類似的調節。
由HIF-1α和HIF-1β組成的異源二聚體——缺氧化還原調節的轉錄因子,HIF-1的活性取決于對氧高度敏感的HIF-1α的穩定性。研究發現,ROS對HIF-1α的調節依賴于其蛋白結構中的ODD域,正常生理條件下產生的H2O2足以引起遍在蛋白酶的磷酸化和HIF-1α降解,而缺氧時這一氧化還原敏感的蛋白降解途徑被抑制,大量HIF-1α與HIF-1β結合形成穩定的二聚體,并易位入核,調節有關基因的表達,如促紅細胞生成素、血管內皮生長因子和血管緊張素(ANG)等的表達,這在低氧條件下機體代償性的增加血供,維持細胞正常的生理功能具有重要意義。
4.胞外刺激引起的胞內ROS產生部位、有關的信號通路以及相應的生物學效應(見表1,圖3)


四、結束語
ROS,尤其是H2O2作為細胞的信使分子,對于細胞增殖分化凋亡的調控、胚胎的正常生長發育和機體穩態的調節具有重要意義。ROS的來源、ROS的作用機制、ROS對不同類型細胞作用的專一性以及ROS如何調節細胞的生死平衡將為近期研究的焦點,進一步的基礎研究也將對認識ROS的生理病理功能和指導臨床相關疾病的有效防治提供新的思路。